«`html
El glucagón es una hormona péptida, producida por las células alfa del páncreas. Aumenta la concentración de glucosa y ácidos grasos en el torrente sanguíneo, y se considera la principal hormona catabólica del cuerpo. El glucagón también se utiliza como medicamento para tratar diversas condiciones de salud. El efecto del glucagón es opuesto al de la insulina, que reduce la glucosa extracelular. El glucagón se produce a partir de proglucagón, codificado por el gen GCG.
El páncreas libera glucagón cuando la cantidad de glucosa en el torrente sanguíneo es demasiado baja. El glucagón provoca que el hígado participe en la glucogenólisis: convirtiendo el glucógeno almacenado en glucosa, que se libera en el torrente sanguíneo. Los niveles elevados de glucosa en sangre, por otro lado, estimulan la liberación de insulina. La insulina permite que la glucosa sea absorbida y utilizada por los tejidos dependientes de insulina. Así, el glucagón y la insulina son parte de un sistema de retroalimentación que mantiene estables los niveles de glucosa en sangre. El glucagón incrementa el gasto energético y se eleva en condiciones de estrés. Pertenece a la familia de hormonas de la secretina.
Función del glucagón
El glucagón generalmente eleva la concentración de glucosa en la sangre promoviendo la glucogénesis y la glucogenólisis. También disminuye la síntesis de ácidos grasos en el tejido adiposo y en el hígado. El glucagón promueve la lipólisis en estos tejidos, lo que provoca que liberen ácidos grasos en la circulación, donde pueden ser catabolizados para generar energía en tejidos como el músculo esquelético cuando es necesario.
La glucosa se almacena en el hígado en forma de glucógeno, que es un glucano (un polímero constituido por moléculas de glucosa). Las células del hígado (hepatocitos) tienen receptores para el glucagón. Cuando el glucagón se une a los receptores de glucagón, las células hepáticas convierten el glucógeno en moléculas individuales de glucosa y las liberan al torrente sanguíneo, en un proceso conocido como glucogenólisis. Cuando el almacenamiento de glucosa se agota, el glucagón estimula al hígado y a los riñones a sintetizar glucosa adicional mediante la gluconeogénesis. El glucagón desactiva la glucólisis en el hígado, causando que los intermediarios glucolíticos sean redirigidos hacia la gluconeogénesis.
El glucagón también regula la tasa de producción de glucosa a través de la lipólisis. El glucagón induce lipólisis en humanos bajo condiciones de supresión de insulina (como en la diabetes mellitus tipo 1).
La producción de glucagón parece depender del sistema nervioso central a través de vías aún no definidas. En animales invertebrados, se ha informado que la eliminación del ojo de tallo afecta la producción de glucagón. La excisión del ojo de tallo en cangrejos de río jóvenes produce una hiperglucemia inducida por glucagón.
Mecanismo de acción del glucagón
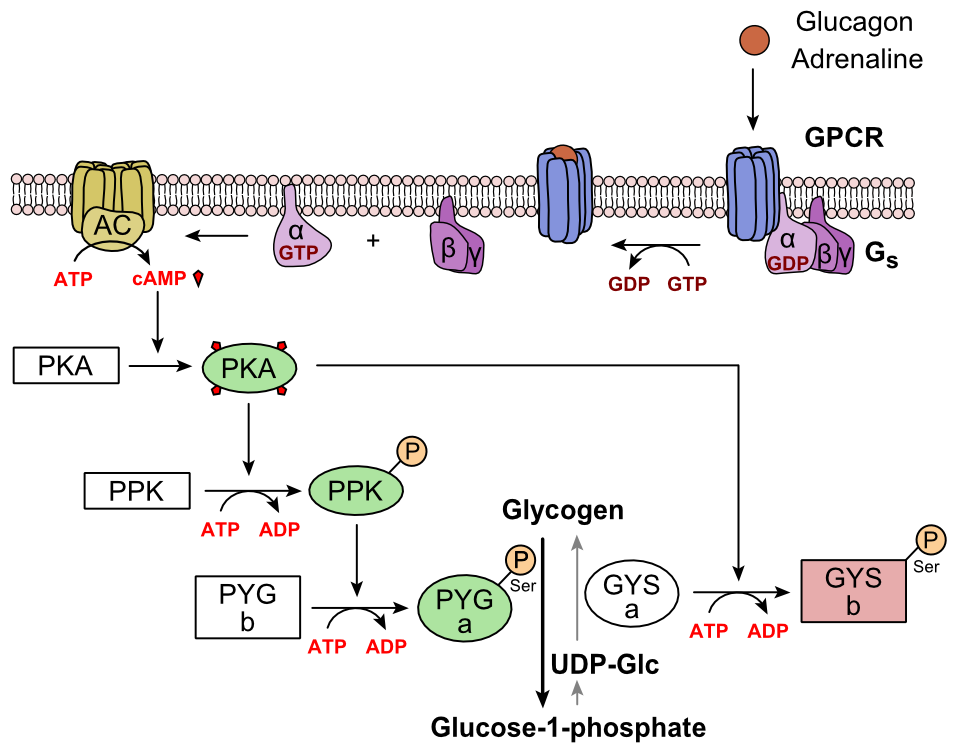
El glucagón se une al receptor de glucagón, un receptor acoplado a proteínas G, ubicado en la membrana plasmática de la célula. El cambio de conformación en el receptor activa proteínas G, que son proteínas heterotriméricas con subunidades α, β y γ. Cuando la proteína G interacciona con el receptor, sufre un cambio conformacional que resulta en el reemplazo de la molécula de GDP que estaba unida a la subunidad α por una molécula de GTP. Esta sustitución provoca la liberación de la subunidad α de las subunidades β y γ. La subunidad alfa activa específicamente la siguiente enzima en la cascada, la adenilato ciclasa.
La adenilato ciclasa fabrica monofosfato de adenosina cíclico (AMP cíclico o cAMP), que activa la proteína quinasa A (quinasa dependiente de cAMP). Esta enzima, a su vez, activa la quinasas de fosforilasa, que luego fosforila la fosforilasa b del glucógeno (PYG b), convirtiéndola en la forma activa llamada fosforilasa a (PYG a). La fosforilasa a es la enzima responsable de la liberación de glucosa 1-fosfato de los polímeros de glucógeno.
Un ejemplo de la ruta sería cuando el glucagón se une a una proteína transmembrana. Las proteínas transmembranales interactúan con Gɑβ𝛾. Gɑ se separa de Gβ𝛾 y se une a la proteína transmembrana adenilato ciclasa. La adenilato ciclasa cataliza la conversión de ATP a cAMP. El cAMP se une a la proteína quinasa A, y el complejo fosforila la quinasa de fosforilasa. La quinasa de fosforilasa fosforilada fosforila la fosforilasa. La fosforilasa fosforilada corta unidades de glucosa del glucógeno como glucosa 1-fosfato.
Además, el control coordinado de la glucólisis y la gluconeogénesis en el hígado se ajusta por el estado de fosforilación de las enzimas que catalizan la formación de un potente activador de la glucólisis llamado fructosa 2,6-bisfosfato. La enzima proteína quinasa A (PKA) que fue estimulada por la cascada iniciada por el glucagón también fosforilará un único residuo de serina de la cadena polipeptídica bifuncional que contiene ambas enzimas fructosa 2,6-bisfosfatasa y fosfofructoquinasa-2. Esta fosforilación covalente iniciada por el glucagón activa la primera y inhibe la segunda. Esto regula la reacción que cataliza la fructosa 2,6-bisfosfato (un potente activador de la fosfofructoquinasa-1, la enzima que es el paso regulador principal de la glucólisis) al ralentizar la tasa de su formación, inhibiendo así el flujo de la vía de glucólisis y permitiendo que la gluconeogénesis predominé. Este proceso es reversible en ausencia de glucagón (y por lo tanto, en presencia de insulina).
La estimulación del glucagón sobre PKA también inactiva la enzima glucolítica piruvato quinasa en hepatocitos.
Fisiología
Producción de glucagón
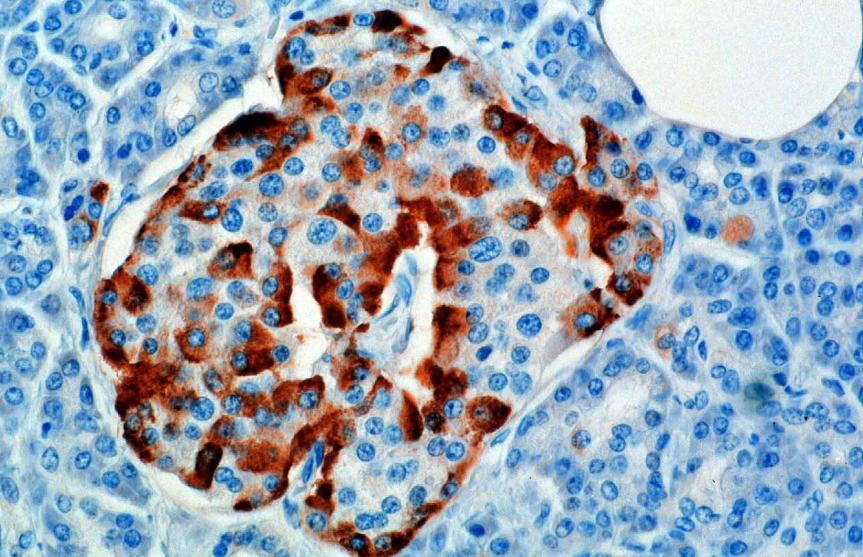
La hormona es sintetizada y secretada por las células alfa (células α) de los islotes de Langerhans, que se encuentran en la parte endocrina del páncreas. La producción, que de otro modo sería continua, es suprimida/ regulada por la amiloide, una hormona péptida co-secretada con insulina por las células β del páncreas. A medida que los niveles de glucosa plasmática disminuyen, la subsiguiente reducción en la secreción de amiloide alivia su supresión sobre las células α, permitiendo la secreción de glucagón.
En roedores, las células alfa están ubicadas en el borde exterior del islote. La estructura del islote humano es mucho menos segregada, y las células alfa están distribuidas por todo el islote en estrecha proximidad a las células beta. El glucagón también es producido por las células alfa en el estómago.
Investigaciones recientes han demostrado que la producción de glucagón también puede llevarse a cabo fuera del páncreas, siendo el intestino el sitio más probable de síntesis de glucagón extrapancreático.
Regulación del glucagón
La secreción de glucagón es estimulada por:
- Hipoglucemia
- Epinefrina (a través de los receptores adrenérgicos β2, α2 y α1)
- Arginina
- Alanina (a menudo proveniente de la transaminación del piruvato/glutamato derivada del músculo)
- Acetilcolina
- Colescistoquinina
- Péptido inhibidor gástrico
La secreción de glucagón es inhibida por:
- Somatostatina
- Amiloide
- Insulina (a través de GABA)
- Heterodímero PPARγ/receptor X retinoide.
- Aumento de ácidos grasos libres y ácidos cetónicos en la sangre.
- Aumento de la producción de urea
- Péptido similar al glucagón-1
Estructura del glucagón
El glucagón es un polipéptido de 29 aminoácidos. Su estructura primaria en humanos es: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-COOH.
El polipéptido tiene una masa molecular de 3485 dalton. El glucagón es una hormona péptida (no esteroide).
El glucagón se genera a partir de la ruptura del proglucagón por la proproteína convertasa 2 en las células α de los islotes pancreáticos. En las células L intestinales, el proglucagón es clevado en los productos alternativos glicentina, GLP-1 (un incretina), IP-2 y GLP-2 (promueve el crecimiento intestinal).
Patología
Los niveles anormalmente elevados de glucagón pueden ser causados por tumores pancreáticos, como el glucagónoma, cuyos síntomas incluyen eritema migratorio necrólitico, reducción de aminoácidos, e hiperglucemia. Puede ocurrir solo o en el contexto de neoplasia endocrina múltiple tipo 1.
El glucagón elevado es el principal contribuyente a la cetoacidosis hiperglucémica en la diabetes tipo 1 no diagnosticada o mal tratada. A medida que las células beta dejan de funcionar, la insulina y el GABA pancreático ya no están presentes para suprimir la producción continua de glucagón. Como resultado, el glucagón se libera de las células alfa al máximo, causando una rápida descomposición del glucógeno en glucosa y una rápida cetogénesis. Se encontró que un subconjunto de adultos con diabetes tipo 1 tardó 4 veces más en promedio en acercarse a la cetoacidosis cuando se les administró somatostatina (inhibe la producción de glucagón) sin insulina. La inhibición del glucagón ha sido una idea popular en el tratamiento de la diabetes, sin embargo, algunos han advertido que hacerlo dará lugar a diabetes frágil en pacientes con glucosa en sangre adecuadamente estable.
La ausencia de células alfa (y por lo tanto de glucagón) se piensa que es una de las principales influencias en la extrema volatilidad de la glucosa en sangre en el contexto de una pancreatectomía total.
Historia
En la década de 1920, Kimball y Murlin estudiaron extractos pancreáticos y encontraron una sustancia adicional con propiedades hiperglucémicas. Describieron el glucagón en 1923. La secuencia de aminoácidos del glucagón fue descrita a finales de la década de 1950. Una comprensión más completa de su papel en la fisiología y la enfermedad no se estableció hasta la década de 1970, cuando se desarrolló un ensayo radioinmuno específico.




